Bulletins scientifiques

Enfin un pas en avant dans le traitement des formes secondaires progressives de sclérose en plaques !
Le 13 décembre 2024 dernier, la Food and Drug Administration (FDA) des États-Unis a accordé la désignation de « médicament innovant » au Tolébrutinib, pour le traitement de la sclérose en plaques secondairement progressive sans poussées, à l’issue d’un essai clinique de phase 3 couronné de succès.
Le Tolébrutinib, développé par la firme Sanofi, est un inhibiteur de la Tyrosine Kinase de Bruton (BTK), une enzyme découverte par Bruton en 1993, présente dans les lymphocytes B, dans les macrophages et les cellules microgliales cérébrales. Ces dernières sont les macrophages spécifiques du cerveau.
Le Tolébrutinib traverse la barrière hémato-encéphalique, et en bloquant cette enzyme particulière, il empêche l’activation aussi bien des lymphocytes B que des cellules macrophagiques. Or ces dernières ont un rôle majeur dans la progression des lésions et donc des symptômes d’une sclérose en plaques en l’absence de poussée clinique.
Elles sont localisées en périphérie des plaques chroniques actives et sont responsables de la destruction continue et insidieuse des gaines de myéline, ce qui conduit à la lente augmentation de volume des lésions démyélinisantes (« chronic expanding lesions »). Elles sont aussi activées par la dégénérecence des fibres nerveuses (axones).

L’étude intitulée HERCULES, de phase 3, a inclus 1131 patients en phase progressive de leur maladie avec absence de poussée durant au minimum les 2 années précédant le début de l’essai clinique. En fait, en moyenne, ces patient n’avaient plus présenté de poussée depuis 7 ans et avaient un score d’invalidité (EDSS) entre 3 (déficit significatif dans une fonction neurologique) et 6, 5 (marche possible avec double appui sur une vingtaine de mètres). 60 % des patients inclus avaient besoin d’une assistance à la marche ce qui indique l’important degré de handicap de la population étudiée.
Le principal résultat de cette étude a été la démonstration que le Tolébrutinib allonge de 31 % le délai avant une progression confirmée du handicap par comparaison avec le groupe placebo. Cette différence est statistiquement très significative. De même, 10 % des participants traités ont présenté une amélioration confirmée du handicap, c’est-à-dire 2 fois plus fréquemment que les personnes sous placebo.
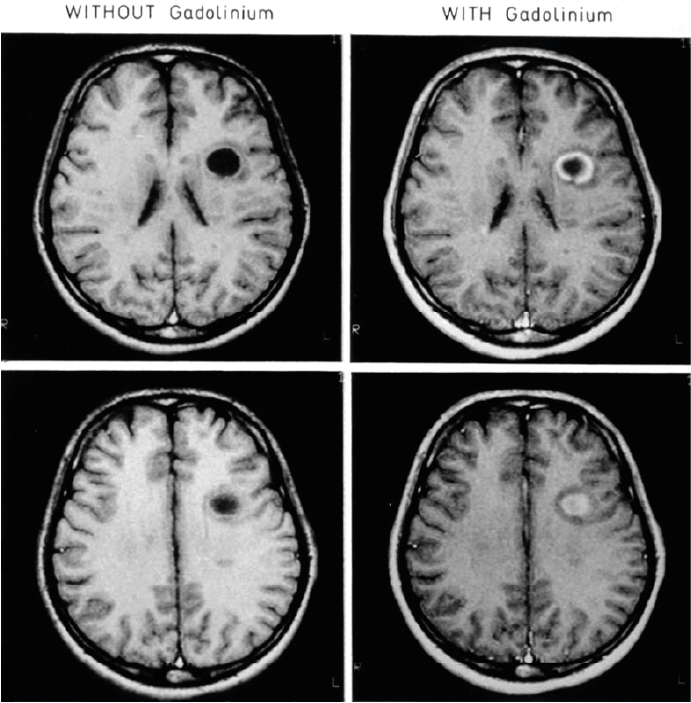
IRM CÉRÉBRALE
révélant une volumineuse lésion démyélinisante, avec destruction
tissulaire au centre ("black hole") et prise de contraste montrant la rupture
de la barrière hémato-encéphalique et le caractère aigu de l'inflammation.
Cette désignation de « médicament innovant » montre que le Tolébrutinib a le potentiel de retarder la progression du handicap et donc de répondre à un besoin médical essentiel pour les personnes atteintes de sclérose en plaques progressive.
Les effets secondaires consistaient essentiellement en une augmentation des enzymes hépatiques au-delà de 3 fois la limite supérieure de la normale, chez 4,1 % des participants (et chez 1,6% dans le groupe placebo). Tous ces cas d’élévation d’enzymes hépatiques se sont résolus sans intervention médicale particulière.
Une étude du Tolébrutinib dans la sclérose en plaques primaire progressive (PERSEUS) est en cours, dont les résultats sont attendus pour le deuxième semestre de 2025.
Ce qui fait certainement la grande différence entre le Tolébrutinib et les autres traitements actuellement utilisés dans la sclérose en plaques est qu’il cible non seulement l’immunité adaptative (lymphocytes B) mais aussi l’immunité innée constituée par les macrophages et les cellules microgliales. L’autre élément important est sa capacité de pénétrer dans le système nerveux central et d’y agir localement au niveau des lésions démyélinisantes.

COMPLEXE OLIGODENDROCYTE-MYÉLINE-AXONE
Cible principale de l'auto-immunité dans la sclérose en plaques
En ciblant spécifiquement les cellules macrophagiques et microgliales, il est certain que de nouvelles voies thérapeutiques s’ouvrent dans la sclérose en plaques. Le futur pourrait être une association de médications immunomodulatrices et anti-inflammatoires, et de médications désactivant les macrophages dès le début même de la maladie.Ceci permettrait d’éviter très précocement la progression indépendante de l’activité des poussées (PIRA ou Progression Independent of Relapse Activity), et ainsi de bloquer simultanément les 2 mécanismes majeurs responsables de la démyélinisation : la démyélinisation aiguë par l’envahissement de cellules sanguines inflammatoires, la démyélinisation chronique par l’activation locale des cellules macrophagiques.
Professeur Émérite Christian Sindic
Bulletin 57
Rester informé·e
Recevez directement dans votre boîte toutes les informations liées à la recherche et à l'actualité de la Fondation Charcot.